Las proteínas constituyen una de las cuatro familias macromoleculares, y es la que presenta una mayor importancia cuantitativa. En el hombre, por ejemplo, constituyen el 16% de su peso total y el 50% del peso seco. Las proteínas son sumamente abundantes en la naturaleza, tanto en vegetales como en animales, en donde se encuentran en una enorme variedad que se manifiesta en los distintos grupos taxonómicos. Esta enorme variedad se corresponde con una alta variedad de funciones, así, la lista que sigue da una idea de la enorme gama de funciones biológicas que las proteínas realizan.
1.- Los catalizadores bioquímicos conocidos como enzimas son proteínas. Las enzimas catalizan la practica totalidad de las reacciones químicas que tienen lugar en las células vivas y aceleran en varios ordenes de magnitud, la velocidad de dichas reacciones. Sin este extraordinario poder catalítico por el cual la velocidad de las reacciones se acelera mas de un millón de veces, no seria posible la vida tal y como la conocemos.
2.- Las proteínas conocidas colectivamente como inmunoglobulinas constituyen la primera barrera de defensa de los organismos contra las infecciones de origen bacteriano o viral.
3.- Las proteínas de transporte llevan materiales a través de las membranas celulares.
4.- Muchas hormonas, como la insulina, son proteínas. Estas proteínas reguladoras controlan muchos aspectos de la función celular, desde el metabolismo hasta la reproducción.
5.- Las proteínas estructurales proporcionan soporte mecánico a los animales, formando también, en algunos casos, sus cubiertas externas.
6.- Ciertos ensamblajes de proteínas llevan a cabo la contracción muscular y posibilitan la motilidad celular, incluyendo el movimiento de las bacterias y del esperma.
7.- El citoesqueleto está compuesto por proteínas.
Esta lista podrá extenderse casi indefinidamente, pero sirve para demostrar la importancia capital de las proteínas.
Constitución de las proteínas. Los aminoácidos.
Las proteínas son cadenas lineales o polímeros de aminoácidos. Si una proteína se hidroliza bajo unas condiciones cuidadosamente controladas, se liberan hasta 20 aminoácidos diferentes. Todos los organismos, desde las bacterias hasta el búfalo, tienen proteínas que están compuestas a partir del mismo juego de 20 aminoácidos, aunque ocasionalmente pueden aparecer modificaciones de éstos. La conformación y la función de una proteína están determinadas por sus aminoácidos componentes y por la secuencia en la que éstos se alinean formando una cadena denominada cadena polipeptídica.
En una proteína cada aminoácido tiene un átomo de carbono central, denominado carbono α. Este carbono α está unido a cuatro grupos: un grupo amino básico (-NH2), un grupo carboxilo ácido (-COOH), un átomo de hidrógeno y un grupo denominado cadena lateral, que es característico para cada aminoácido. Esta cadena lateral a la que se suele hacer referencia como -R, confiere a cada aminoácido su identidad. Los átomos de carbono de la cadena lateral se nombran de forma secuencial como β, γ, δ y ε. Los grupos de cada aminoácido se nombran de acuerdo al átomo de carbono al cual están unidos. Por ejemplo, el grupo amino unido al carbono α se denomina α-amino. Los aminoácidos cuando tienen un carbono al cual se le unen cuatro grupos diferentes (como en el carbono α de todos los aminoácidos, excepto la glicocola) pueden aparecer dos isómeros que están relacionados entre sí por tratarse de imágenes especulares no superponibles. Estos isómeros se denominan enantiómeros y se dice de ellos que son quirales, palabra derivada del vocablo griego que significa mano. Esta última denominación es muy apropiada porque las parejas de imágenes especulares están relacionadas entre sí como la mano izquierda con la derecha. Por razones históricas, las parejas de imágenes especulares se denominan D (por dextro o derecha) y L (por levo o izquierda). Estos términos definen las posiciones reales en el espacio, o configuraciones, de los átomos que rodean al carbono, pero no definen la rotación óptica de los isómeros. Todos los aminoácidos, pueden existir tanto en la configuración D como en la L. Por lo tanto, es en cierto modo sorprendente que todos los aminoácidos quirales que aparecen en las proteínas tengan la configuración L. Esto es debido a que las proteínas se forman con la ayuda de unas enzimas que insertan únicamente L-aminoácidos en la cadena proteica.
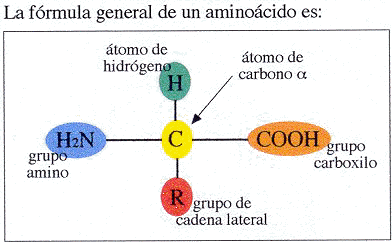
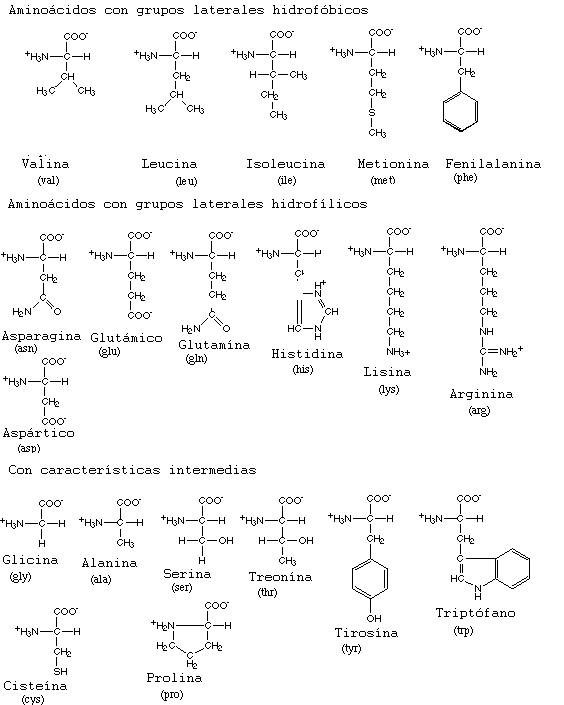
Un aminoácido se diferencia de otro por su cadena lateral, -R. Un vistazo a las estructuras de los 20 aminoácidos encontrados comúnmente en las proteínas pone de manifiesto que estas cadenas laterales varían considerablemente, permitiendo que estos aminoácidos los podamos clasificar en cuatro grandes grupos:
- Aminoácidos con cadenas laterales hidrofóbicas. Existen aminoácidos como la alanina, la valina, la leucina, etc, que poseen como cadenas laterales hidrocarburos saturados. Esta composición en sus cadenas laterales les hace que sean químicamente inertes, jugando un papel importante en el establecimiento y mantenimiento de estructuras terciarias de diversas proteínas.
- Aminoácidos con cadenas laterales hidrofílicas cargadas negativamente. Es el caso de aminoácidos como el aspartato o el glutamato, que contienen en sus cadenas laterales grupos carboxilos, que a pH fisiológico se encuentran desprotonados, adquiriendo cierta carga negativa muy importante en la adquisición de las diversas estructuras secundaria y terciaria.
- Aminoácidos con cadenas laterales hidrofílicas cargadas positivamente. Aminoácidos como la lisina o arginina contienen en sus cadenas laterales grupos básicos que a pH fisiológico están cargados positivamente, cumpliendo funciones muy importantes, ya que por ejemplo, en el caso de las enzimas, estos aminoácidos intervienen en la catálisis ácido-base.
- Aminoácidos con cadenas laterales hidrofílicos sin carga. A este grupo pertenecen aminoácidos como la serina, glutamina o la tirosina. Son aminoácidos que a pesar de no encontrarse ionizados a pH fisiológico si se comportan como polares.
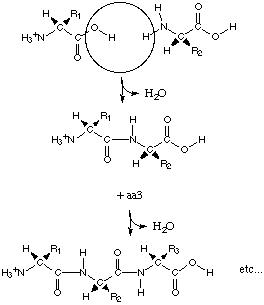
El enlace peptídico.
Cuando los aminoácidos se unen para formar una cadena, lo hacen mediante un tipo de enlace denominado enlace peptídico. Este se forma porque el grupo a-carboxilato de un aminoácido se condensa con un grupo a-amino de otro aminoácido, perdiéndose una molécula de agua. El resultado es la formación de un enlace amida entre el grupo carbonilo (C=O) de un aminoácido y el grupo amino (N-H) del siguiente.
Cuanto más comprensible parece el universo, más absurdo parece también. Steven Weinberg.
Ad orbis per scientiam